Patologia do câncer de mama após terapia neoadjuvante sistêmica (quimioterapia/ hormonioterapia)
Isnard Elman Litvin (CRM 21366) e Guilherme Portela Coelho (CRM 23795)
- O câncer de mama é a segunda neoplasia maligna mais frequente no mundo e a principal causa de óbito por câncer no sexo feminino.
- Apesar da abrangência crescente do rastreamento para diagnóstico do carcinoma mamário, ainda se observa uma incidência de casos localmente avançados no mundo entre 10 a 20% do total de diagnósticos, podendo alcançar até 60% dos casos novos em alguns países em desenvolvimento.
- Uma metanálise, que incluiu 11.955 pacientes, inicialmente apresentada no San Antonio Breast Cancer Symposium de 2012 e publicada em 2014 no The Lancet por Cortazar et al., mostra que a resposta patológica definida como ypT0ypN0 ou ypT0/isypN0 foi associada com melhores resultados ao longo prazo, além de mostrar forte valor prognóstico, principalmente para os subtipos agressivos de câncer de mama.
- O referido estudo avaliou resposta patológica completa (RCp), sobrevida livre de eventos (SLE); e sobrevida global (SG).
- As definições mais comumente usadas de RCp são:
- ypT0ypN0 (ausência de câncer invasivo e câncer in situ na mama e axila);
- ypT0/is ypN0 (ausência de câncer invasivo na mama e axila, independentemente do carcinoma ductal in situ) 24
- ypT0/is (ausência de câncer invasivo nos tumores de mama, independentemente de carcinoma ductal in situ ou envolvimento linfonodal).
- A RCp global foi de 22% para ypT0/is, 18% para ypT0/is ypN0 e 13% para ypT0 ypN0. Em geral, os pacientes que alcançaram uma RCp em qualquer definição teve maior SLE e SG do que aqueles com câncer invasivo residual.
- A taxa de resposta varia de acordo com: o perfil imuno-histoquímico e com o grau histológico:
- A taxa de RCp foi baixa nos pacientes com tumor receptor hormonal (RH) positivo de baixo grau;
- A taxa de RCp duplicou para os tumores RH positivo de alto grau;
- As taxas de resposta foram maiores nos tumores com HER2 amplificado HER- 2 positivo e nos triplo- negativos.
- Estes achados apoiam a indicação de quimioterapia né-adjuvante nos casos de tumores sem expressão de receptores hormonais (RH), ou nos que expressam RH e apresentam perfil Luminal B símile (ver capítulo de classificação molecular do carcinoma mamário).
- A avaliação anatomopatológica do espécime cirúrgico após tratamento sistêmico neoadjuvante serve, entre outras coisas, para avaliar a eficácia da terapia neoadjuvante.
- Alguns Sistemas de Classificação da Resposta Pós-terapia Neoadjuvante:
|
AUTOR |
ANO |
NOME DO SISTEMA |
PACIENTES (n) |
pCR (%) |
|
Chevallier B et al |
1993 |
Chevallier |
45 |
26 |
|
Sataloff DM et al |
1995 |
Sataloff |
36 |
28 |
|
Fisher ER et al |
2002 |
NSABP B18 |
1234 |
20 |
|
Ogston KN et al |
2003 |
M-P grade |
176 |
14 |
|
Carey LA et al |
2005 |
AJCC |
132 |
24 |
|
Symmans WF et al |
2007 |
RCB |
432 |
17 |
- Nós do Laboratório Diagnose nosso serviço utilizamos o Sistema de Symmans WF et al, pois avalia linfonodoa axila simultaneamente, subdivide a resposta parcial, e informa carga residual tumoral (como um tipo de variável).
- Neste sistema são avaliadas seis (6) variáveis pós-terapia sistêmica neoadjuvante para determinar dois valores:25
- O valor da carga residual de câncer e a classe da carga residual de câncer.
- A carga residual de tumor é avaliada tanto no leito tumoral primário (tecido mamário), quanto nos linfonodos regionais.
- No tecido mamário são avaliadas:
- A área em milímetros do leito tumoral primário, a celularidade percentual do tumor e, o percentual de doença “in situ”.
- Nos linfonodos regionais são avaliados:
- O número de linfonodos positivos e o diâmetro em milímetros da maior metástase.
- Para se calcular a carga residual de câncer e a classe da carga residual de câncer, é utilizada a fórmula: (RCB =1.4 (dprim x finv) 0.17 [4 (dmet x (1 – 0.75LN)] 0.17), disponível no site do MD Anderson, a qual utiliza os critérios relatados acima, os quais serão explicados nos parágrafos abaixo.
- O estudo do tecido dos espécimes cirúrgicos é dividido em três (3) fases:
- Informações antes do tratamento sistêmico neoadjuvante, exame macroscópico pós tratamento sistêmico neoadjuvante e o exame microscópico pós-tratamento sistêmico neoadjuvante.
- Uma equipe multidisciplinar composta por cirurgião, radiologista, oncologista e patologista visa a indicar corretamente a terapia neoadjuvante e mapear de modo inteligente o leito tumoral residual.
- Inicialmente deve ser realizada uma punção-biópsia da mama e avaliação dos linfonodos regionais.
- No laudo anatomopatológico da punção-biópsia da mama devem constar as seguintes informações:26
- Tipo histológico do carcinoma
- Grau histológico
- Celularidade percentual de tumor
- Relato de presença de carcinoma “in situ”, se houver.
- As reações para o exame imuno-histoquímico devem ser padronizadas. No nosso serviço, são executadas e reveladas por sistema totalmente automatizado Dako Agilent, PT-Link e Autostainer.
- Exame imuno-histoquímico utilizando as metodologias padronizadas pela literatura internacional do PEPI score (no caso de hormonioterapia) e do Allread score para os anticorpos:
- Receptor de estrógeno (no nosso serviço: anticorpo FLEX da Dako/Agilent)
- Receptor de progesterona (anticorpo FLEX da Dako) (no nosso serviço: anticorpo FLEX da Dako/Agilent)
- KKi-67 (anticorpo FLEX da Dako) (no nosso serviço: anticorpo FLEX da Dako/Agilent);
- HERer-2 (clone SP3 da Spring, no nosso serviço).
- Os linfonodos regionais são avaliados por meio de ecografia e quando suspeitos pode ser recomendada a punção aspirativa com agulha fina (PAAF) encaminhando o material para exame citopatológico ou eventualmente punção-biópsia com agulha grossa (core biopsy) para exame histopatológico.
- Informações necessárias importantes de serem fornecidas ao laboratório de patologia antes do exame macroscópico de espécime pós-terapia neoadjuvante sistêmica:
- Idade da paciente,
- Indicação da terapia neoadjuvante,
- Tipo de terapia neoadjuvante,
- Lateralidade da mama envolvida pelo tumor,
- Localização exata do tumor (quadrante),
- Presença ou não de clipe no leito tumoral e/ou no linfonodo,
- Tamanho do tumor pré-tratamento,
- Pelo menos um exame de imagem,
- Informações sobre os linfonodos regionais com auxílio de exames de imagem e o tipo de procedimento cirúrgico realizado.
- Na segunda fase é realizado o exame macroscópico da peça cirúrgica. Tumores maiores que 1,0cm e não fixados podem ser congelados e enviados para biobancos 27:
- Segunda fase: Como realizado na rotina do laboratório de patologia, inicia-se orientando a peça cirúrgica pós-tratamento neoadjuvante tendo como informações:
- A lateralidade,
- O quadrante,
- Fios cirúrgicos de reparo (designados como curto=cranial, longo=lateral e médio=medial),
- Presença de fio metálico ou de clipe metálico e pelo menos um exame de imagem.
- A peça é pesada, medida e as margens cirúrgicas são pintadas com tinta nanquim.
- A peça é cortada em fatias de 0,5cm de espessura de antero-superior para postero-inferior e cada fatia é rotulada como 1, 2, 3, etc, e subdividida em letras A, B, C, etc. (do eixo superior para inferior), montando-se um gráfico de coordenadas e para melhor avaliar o leito tumoral.
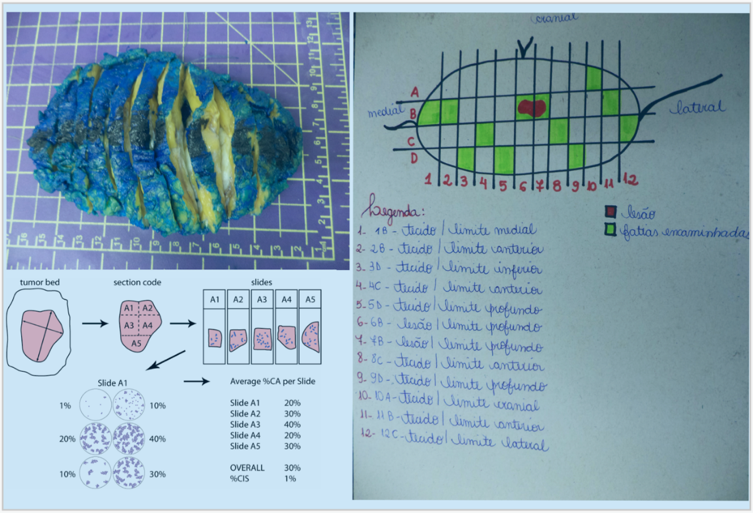
Metodologia para manuseio do espécime visando a estimar presença e características do tumor residual
Se, por exemplo, o tumor estiver em quatro lâminas de fatias consecutivas, a extensão do tumor será 4 x 0,3 = 1,2cm.
- Procura-se então, identificar a presença de tumor residual.
- Havendo tumor residual deve-se relatar a localização do tumor, a medida do tumor em milímetros, e, se o tumor é unifocal ou multifocal.
- Não se encontrando tumor residual, relata-se a presença de alterações como, por exemplo, fibrose ou áreas de adensamento, sua localização e sua dimensão.
- São feitos cortes representativos do leito tumoral para a confecção de lâminas histológicas.
- A terceira fase é o exame microscópico de lâminas coradas pelo método da hematoxilina e eosina. Neste momento, relatar-se a presença ou não de tumor residual na mama e nos linfonodos regionais.
- Havendo tumor residual informa-se:
- Tamanho do tumor residual em milímetros (dois maiores eixos)
- Grau histológico,28
- Percentual de celularidade residual de acordo com o escore de Miller-Payne
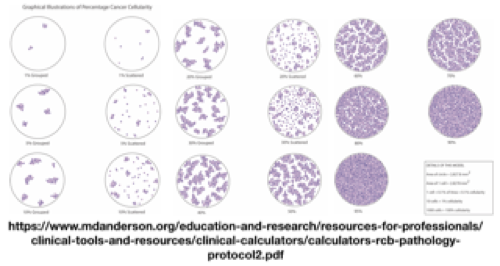
Diagramas ilustrativos para orientação da categorização da celularidade tumoral residual
- Se há carcinoma “in situ” e o percentual de carcinoma “in situ”,
- Invasão angiolinfática (com auxílio do exame imunohistoquímico utilizando os anticorpos que identificam células do endotélio vascular, por exemplo, CD31, CD34 Podoplanina, quando necessário),
- Distância da margem cirúrgica em milímetros e presença ou ausência de linfócitos infratumorais e presença ou ausência de microcalcificações.
- Não havendo tumor residual relata-se a presença de fibrose, necrose, atrofia ou outras alterações da mama.
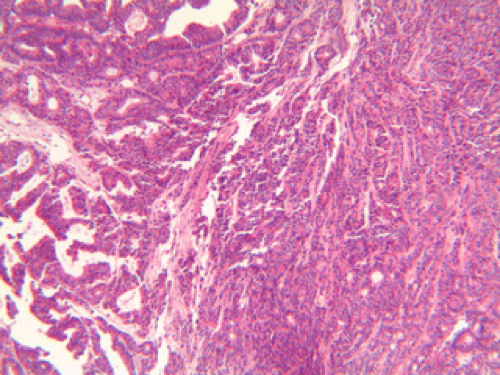
Morfologia de um carcinoma previamente a quimioterapia neo-adjuvante (observar a densidade tumoral), H&E, 100x
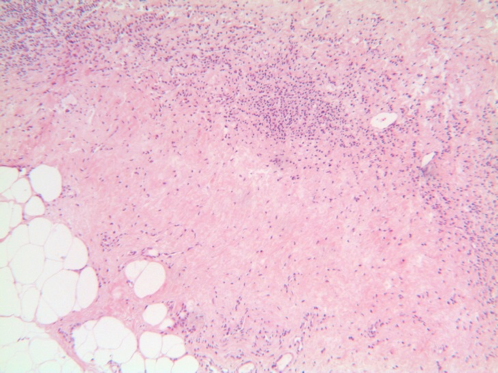
Morfologia de um carcinoma após quimioterapia neo-adjuvante, com Resposta Patológica Completa (RPC), H&E, 100x
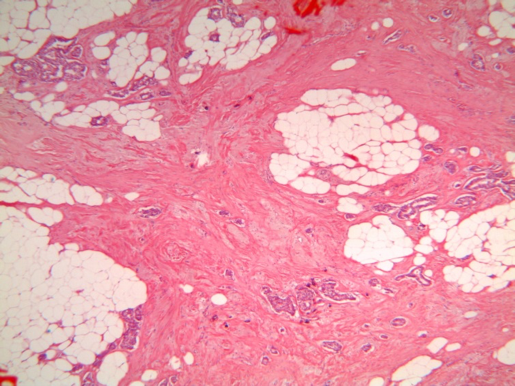
Morfologia de um carcinoma após quimioterapia neo-adjuvante, sem RPC (observar a densidade tumoral -resposta parcial), H&E, 100x
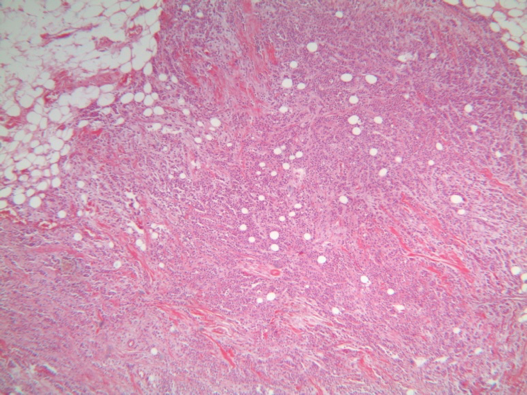
Morfologia de um carcinoma após quimioterapia neo-adjuvante, sem RPC (observar a densidade tumoral- resposta insignificante, compatível com tipo e grau histológico pré-QT - Lobular Clássico, grau 1), H&E, 100x
- Os linfonodos são cortados em fatias de 2,0 milímetros e totalmente incluídos para análise microscópica; após coloração pelo método da hematoxilina e eosina, relata-se:
- O número total de linfonodos isolados,
- Em quantos linfonodos há metástase,
- A medida do maior foco de metástase,
- A presença ou ausência de extensão extranodal,
- A presença ou ausência de micrometástase (foco menor que 2,0 milímetros)
- A presença ou ausência de células tumorais isoladas.
- Caso haja discordância entre o tamanho do tumor residual no exame macroscópico e no exame microscópico, considera-se o de maior tamanho.
- Há indicação de repetição do exame imuno-histoquímico já realizado na biópsia de mama, quando:
- O resultado na biópsia for negativo ou equívoco,
- Carcinoma invasor for mínimo na biópsia,
- Exame realizado em outra instituição não padronizada,
- Tumor heterogêneo morfologicamente,
- Não haver resposta esperada ao tratamento,
- Receptor de Estrógeno negativo,
- HER-2 negativo ou
- Em caso de triplo-negativo.
- A invasão angiolinfática sem massa de neoplasia residual invasora é um evento raro que deve ser relatado e mensurado, mas não deve ser considerado no cálculo do
RCB. Esta situação deve ser diferenciada do carcinoma “in situ” e de artefatos de retração, por vezes sendo necessário o estudo imuno-histoquímico para elucidação diagnóstica.
REFERÊNCIAS
- Colleoni M, Orvieto E, Nolè F et al. Prediction of response to primary chemotherapy for operable breast cancer. Eur J Cancer 1999; 35: 574–579.
- Andea AA, Wallis T, Newman LA, Bouwman D, Dey J, Visscher DW.Pathologic analysis of tumor size and lymph node status in multifocal/multicentric breast carcinoma.Cancer. 2002 Mar 1;94(5):1383-90.
- Kuroi K, Toi M, Tsuda H, Kurosumi M, Akiyama F. Issues in the assessment of the pathologic effect of primary systemic therapy for breast cancer. Breast Cancer. 2006;13(1):38-48.
- Pinder SE, Provenzano E, Earl H, Ellis IO. Laboratory handling and histology reporting of breast specimens from patients who have received neoadjuvant chemotherapy.Histopathology. 2007 Mar;50(4):409-17.
5.Lester SC, Bose S, Chen YY, Connolly JL, de Baca ME, Fitzgibbons PL, Hayes DF, Kleer C, O’Malley FP, Page DL, Smith BL, Weaver DL, Winer E; Members of the Cancer Committee, College of American Pathologists. Protocol for the examination of specimens from patients with ductal carcinoma in situ of the breast.Arch Pathol Lab Med.2009 Jan;133(1):15-25.
- Lester SC. Pathology of breast carcinomas after neoadjuvant chemotherapy: an overview with recommendations on specimen processing and reporting.Arch Pathol Lab Med. 2009 Apr;133(4):633- 42.
- Lester SC, Bose S, Chen YY, Connolly JL, de Baca ME, Fitzgibbons PL, Hayes DF, Kleer C, O’Malley FP, Page DL, Smith BL, Tan LK, Weaver DL, Winer E; Members of the Cancer Committee, College of American Pathologists.Protocol for the examination of specimens from patients with invasive carcinoma of the breast.Arch Pathol Lab Med. 2009 Oct;133(10):1515-38.
30
- Thomassin-Naggara I, Lalonde L, David J, Darai E, Uzan S, Trop I. A plea for the biopsy marker: how, why and why not clipping after breast biopsy? Breast Cancer Res Treat. 2012 Apr;132(3):881-93.
- Muenst S et al. Expression of programmed death ligand 1 (PD-L1) is associated with poor prognosis in human breast cancer.Breast Cancer Res Treat. 2014 Jul;146(1):15-24.
- Cortazar P, Zhang L, Untch M, et al. Pathological complete response and long-term clinical benefit in breast cancer: the CTNeoBC pooled analysis. Lancet 2014.
- Montagna E, Bagnardi V, Viale G, Rotmensz N, Sporchia A, Cancello G, Balduzzi A, Galimberti V, Veronesi P, Luini A, Mastropasqua
MG, Casadio C, Sangalli C, Goldhirsch A, Colleoni M. Changes in PgR and Ki-67 in residual tumour and outcome of breast cancer patients treated with neoadjuvant chemotherapy.Ann Oncol. 2015 Feb;26(2):307-13
- Youn I, Choi SH, Kook SH, Choi YJ, Park CH, Park YL, Kim DH.Ultrasonography-guided surgical clip placement for tumor localization in patients undergoing neoadjuvant chemotherapy for breast cancer.J Breast Cancer. 2015 Mar;18(1):44-9.
- Wang-Lopez Q, Chalabi N, Abrial C, Radosevic-Robin N, Durando X, Mouret-Reynier MA, Benmammar KE, Kullab S, Bahadoor M, Chollet P, Penault-Llorca F, Nabholtz JM. Can pathologic complete response (pCR) be used as a surrogate marker of survival after neoadjuvant therapy for breast cancer? Crit Rev Oncol Hematol. 2015 Jul;95(1):88-104.
- Provenzano E, Bossuyt V, Viale G, Cameron D, Badve S, Denkert C, MacGrogan G, Penault-Llorca F, Boughey J, Curigliano G, Dixon JM, Esserman L, Fastner G, Kuehn T, Peintinger F, von Minckwitz G, White J, Yang W, Symmans WF; Residual Disease Characterization Working Group of the Breast International Group-North American
Breast Cancer Group Collaboration.Standardization of pathologic evaluation and reporting of postneoadjuvant specimens in clinical trials of breast cancer: recommendations from an international working group.Mod Pathol. 2015 Sep;28(9):1185-201.
- Caudle AS et AL. Improved Axillary Evaluation Following Neoadjuvant Therapy for Patients With Node-Positive Breast Cancer Using Selective Evaluation of Clipped Nodes: Implementation of Targeted Axillary Dissection. J Clin Oncol. 2016.
16.http://www3.mdanderson.org/app/medcalc/index.cfm?pagename= jsconvert3- 08/02/2016 – 10:00
31
- https://www.mdanderson.org/education-and-research/resourcesforprofessionals/ clinical-tools-and-resources/clinical-calculators/ calculators-rcb-pathology-protocol2.pdf - 08/02/2016 - 10:00
- http://www.mdanderson.org/breastcancer_RCB. - 08/02/2016 - 10:00. See comment in PubMed Commons below





