Avaliação histopatológica do Linfonodo Sentinela no câncer de mama
Renata Fragomeni Almeida (CRM 36744) e Guilherme Portela Coelho (CRM 23795)
- O estado linfonodal é um dos fatores prognósticos mais importantes no câncer de mama, além de estar intimamente relacionado com a sobrevida.
- Quando há envolvimento ganglionar, a taxa de recidiva é de 70%, enquanto que, nas pacientes com linfonodo negativo é de 20%. Além disso, o número de linfonodos acometidos e a presença de invasão extra capsular também contribuem para o aumento do risco de recidiva da doença.
- Até o início da década de 80, tanto as mastectomias, quanto as cirurgias conservadoras eram seguidas do esvaziamento axilar completo. No entanto, complicações como linfedema, diminuição do sensório, formação de seroma e dor ocorriam em 20 a 55% dos casos.
- A biópsia do linfonodo sentinela (LS) está associada à menor morbidade no pós-operatório. A incidência de linfedema nos pacientes submetidos à linfadenectomia axilar completa é de 30%, enquanto que nos pacientes que realizaram apenas biópsia do linfonodo sentinela varia entre 3,5 e 11%.
- Essas complicações locais axilares contribuem fortemente para a morbidade e diminuição da qualidade de vida no longo prazo.
- O linfonodo sentinela é definido como o primeiro linfonodo a receber a drenagem linfática vinda do tumor primário. No pré-operatório, injeta-se o contraste azul e o marcador radioativo na mama por abordagem peritumoral, periareolar ou intradérmica. A partir daí, identifica-se o linfonodo marcado com 24• o radioisótopo, que pode ser supraclavicular, infraclavicular, paraesternal ou, mais comumente, axilar. Uma incisão é feita no local, retirando-se os linfonodos de interesse para análise.
- O exame transoperatório de congelação (ETOC) é o método mais utilizado para avaliar o linfonodo sentinela. Uma meta-análise, que incluiu 47 estudos sobre ETOC no LS, encontrou uma sensibilidade de 73%, com grande diferença entre a detecção de macrometástase e de micrometástase (94% versus 40%).
- A maioria dos estudos concorda com uma taxa de falsos-negativos de 10%, ocorrendo principalmente nos casos de micrometástases, de células tumorais isoladas e de carcinoma lobular bem diferenciado. Esta taxa também sofre influência da técnica utilizada e da quantidade de superfície linfonodal amostrada durante o exame.
- Entre as desvantagens do método de congelação estão: tempo consumido durante a cirurgia, presença de distorção artefatual do tecido devido à congelação e potencial perda de material devido à técnica de desbastamento.
- O método de citologia também pode ser utilizado, entretanto, tem a desvantagem de não se poder avaliar a arquitetura linfonodal, impedindo a avaliação do tamanho da metástase. Uma meta-análise avaliou 31 estudos sobre a citologia/imprint na avaliação do LS e encontrou uma sensibilidade de 63%, também com diferença entre a detecção de micro e macrometástase.
- Não existe ainda uma recomendação padrão da avaliação do LS durante o exame transoperatório, observando-se grande variação entre os laboratórios.
- O nosso serviço utiliza o seguinte protocolo: cada LS isolado é cortado no maior eixo, fazendo-se um imprint da superfície das duas metades. Após, é realizado o corte histológico de ambas em criostato, aprofundando cerca de 2,0mm. Assim, são avaliadas no mínimo 4 superfícies do LS durante o ETOC. O tecido restante é enviado para estudo anatomopatológico convencional.

IMAGEM 1: Cada linfonodo presente no espécime referido pelo cirurgião como linfonodo sentinela é isolado do tecido adiposo circunjacente.

IMAGEM 2: Cada linfonodo é incisado e partido em duas metades, incisão está sempre no plano paralelo às duas maiores dimensões do gânglio. As superfícies incisadas, das duas metades, são expostas ao contado com lâmina de microscopia para gerar o “imprint” a ser examinado citologicamente.

IMAGEM 3: Congelamento do tecido linfonodo em criostato de alta resolução.

IMAGEM 4: Tecido após desbaste de cerca de 1-2 micrômetros, posicionado no interior do criostato (esquerda) e lâminas contendo o respectivo corte histológico corado pelo H&E e citologia corada por MGG.
- A recomendação atual para a avaliação do LS no exame anatomopatológico definitivo é de seja removido o tecido adiposo e que sejam isolados cuidadosamente todos os linfonodos.
- Os guidelines da CAP e da ASCO recomendam que sejam feitos cortes seriados do linfonodo no maior eixo, em intervalos de 2mm. Deve-se tomar cuidado para que seja avaliada a maior superfície possível, incluindo-se totalmente cada linfonodo no bloco de parafina. Após, os cortes corados com Hematoxilina-Eosina devem ser analisados a fim de que sejam identificadas tanto as macrometástases (definida como maior de 2,0mm) quanto as micrometástases (menor ou igual a 2,0mm) e as células tumorais isoladas (menor ou igual a 0,2mm ou menos de 200 células).
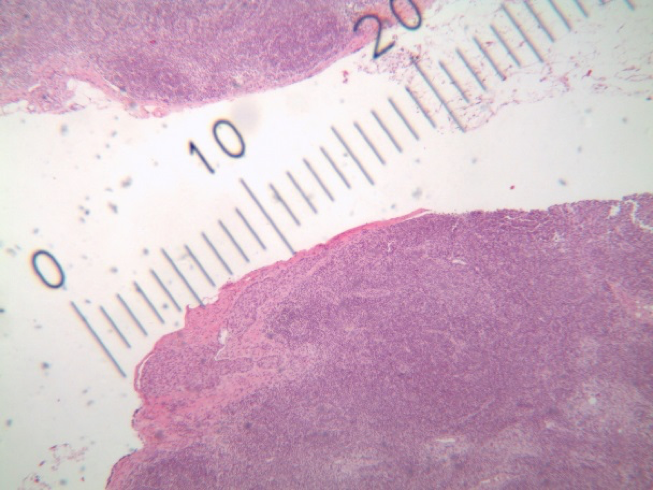
IMAGEM 5: H&E, 40x - Corte histológico de linfonodo sentinela demonstrando metástase subcapsular menos do que 2,0mm (micrometástase).
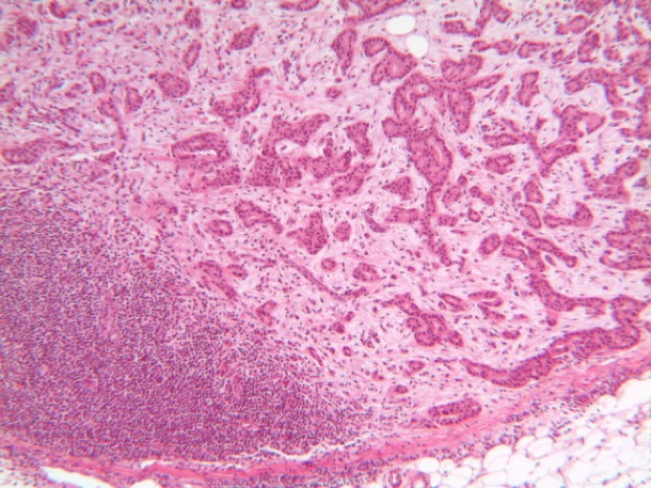
IMAGEM 6: H&E, 100x - metástase maior do que 2,0mm (direita); tecido linfóide (esquerda).
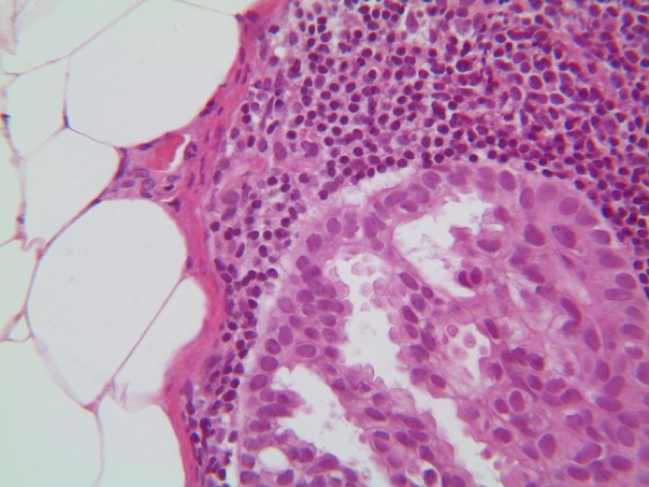
IMAGEM 7: H&E, 400x - diminuto foco metastático (direita/inferior) em tecido linfóide com lipossubstituição
- Cortes adicionais e uso de imunoistoquímica devem ser avaliados individualmente pelo patologista, não sendo recomendados de rotina.
TABELA 1: Estudos que relacionaram a positividade do linfonodosentinela com a presença de metástase axilar após esvaziamento completo
|
ESTUDOS |
RESULTADOS |
|
Turner et al. (1997) |
Se o LS for negativo, a chance de metástase é menor do que 0,1% |
|
Weavet et al. (2000) |
Sensibilidade do LS em detectar metástase axilar de 88% com especificidade de 100% com acurácia de 96,4%. Além disso, comprovou que metástases ocultas no LS não apresentavam impacto na sobrevida em 5 anos |
|
Nos et al. (2003) |
Em 39% dos casos de macrometástases no LS, foi encontrada metástase axilar após o esvaziamentos completo. Esse número cai para 7% quando foram identificadas micrometástases pela coloração usual (HE) e para 6% quando as células tumorais foram identificadas apenas com o método complementar de imunohistoquímica. |
|
Cserni et al. (2004) |
Aumento de 62% no risco de metástase axilar para cada centímetro de tumor, de 13% para cada milímetro do tamanho da metástase no LS e de 192% quando há invasão extracapsular do LS |
|
Krag et al. (2010) no estudo NSABP B-32 |
Demonstraram que a biópsia do LS era equivalente ao esvaziamento completo nos casos T1 ou T2 com cNO quanto à sobrevida e ao controle regional |
|
Giuliano et al. (2010), no estudo COZOG Z0011 |
Não há diferença estatisticamente significativa na sobrevida e na taxa de recidiva entre os pacientes que apresentavam 1 ou 2 LS metastáticos e realizaram esvaziamento radical e os que realizaram apenas biópsia do LS |
|
Zhou et al. (2012) |
Os fatores mais importantes para a presença de metástase linfonodal foram o tamanho tumoral, o tamanho da metástase no LS e o grau histológico do tumor. Quanto a classificação molecular, os subtipos Luminal A e Luminal B foram os que apresentaram os maiores riscos. |
|
Gülben et al. (2014) |
Este estudo não encontrou associação entre o tamanho da metástase e a invasão extracapsular do LS com a presença de metástases em outros linfonodos axilares. Entretanto, o tamanho do tumor primário, a presença de invasão angiolinfática, o grau histológico e o subtipo do tumor (Luminal HER-2 e Superexpressão do HER-2) foram identificados como fatores de risco para metástase axilar. |
|
Poling et al. (2014) |
Utilizando o método de analisar apenas metade do LS durante o ETOC, encontraram sensibilidade de 76% com especificidade de 99,9% e 4,9% de falsos-negativos. O tamanho da metástase no LS dos casos de falso-negativos variou entre 0,05 e 16mm. Em 74% desses casos a discrepância ocorreu pela amostra de tecido (localização de metástase na outra metade não examinada ou encontrada após aprofundar o bloco de parafina). |
|
Marazzo et al. (2015) |
Demonstraram relação entre invasão angiolinfática e tamanho do tumor com linfonodos axilares positivos. O subtipo Triplo Negativo se mostrou como efeito negativo na presença de metástase. |
|
Bishop et al. (2016) |
Encontraram LS positivo em 19% dos casos de câncer de mama em estágio T1 e T2 com cNO. A grande maioria destes apresentava metástase limitada e, no máximo, 2 linfonodos. Apenas 3% dos casos tinham indicação de esvaziamento axilar radical. |
LS = Linfonodo Sentinela; HE = Hematoxilina-Eosina
REFERÊNCIAS
Andree C, Schmidt VJ, Munder BIJ, Seidenstücker K, Behrendt P,
Witzel C et al. Detecting of breast cancer metastasis by means of regional lymph node sampling during autologous breast reconstruction – a screening of 519 consecutive patients. Med SciMonit. 2012;18(10):CR605-610.
Bishop JA, Sun J, Ajkay N, MD, Sanders MA. Decline in Frozen Section Diagnosis for Axillary SentinelLymph Nodes as a Result of the American College ofSurgeons Oncology Group Z0011Trial. Arch Pathol Lab Med – Vol 140, August 2016.
Buitrago F, Uemura G, Sena MCF. Fatores prognósticos em câncer de mama. Com. Ciências Saúde. 2011; 22 Sup 1:S69-S82.
Cserni G, Burzykowski T, Vinh-Hung V, Kocsis L, Boross G, Sinko M et al. Axillary Sentinel Node and Tumour-related Factors Associated with Nonsentinel Node Involvement in Breast Cancer.Jpn J ClinOncol 2004; 34(9)519– 524.
Giuliano AE, McCall L, Beitsch P, Whitworth PW, Blumencranz P, Leitch AM et al. Locoregional recurrence after sentinel lymph node dissection with or without axillary dissection in patients with sentinel lymph node metastases: the American College of Surgeons Oncology Group Z0011 randomized trial. Ann Surg 2010;252:426–32; discussion 32-3.
Giuliano AE, Hunt KK, Ballman KV, Beitsch PD, Whitworth PW, Blumencranz PW et al. Axillary dissection vs no axillary dissection in women with invasive breast cancer and sentinel node metastasis: a randomized clinical trial. JAMA 2011;305:569–75.
Goodman S, O´Connor A, Kandil D, Khan A. The Ever-Changing Role of Sentinel Lymph Node Biopsy in the Management of Breast Cancer. Arch Pathol Lab Med. 2014;138:57-64.
Gournay ED, Guyomard A, Coutant C, Boulet S, Arveux P, Causeret
S et al. Impact of sentinel node biopsy on long-term quality of life in breast cancer patients. British Journal of Cancer.2013;109,2783-2791.
Gülben K, Berbero›lu U, Aydo›an O, Kýna. V. Subtype Is a Predictive Factor of Nonsentinel Lymph Node Involvement in Sentinel Node- Positive Breast Cancer Patients. J Breast Cancer. 2014;17(4):370-37.
Krag DN, Anderson SJ, Julian TB, et al. Sentinel-lymph-node resection compared with conventional axillary-lymph-node dissection in clinically node-negative patients with breast cancer: overall survival findings from the NSABP B-32 randomised phase 3 trial.LancetOncol.
2010;11(10):927–933.
Lester SC, Bose S, Chen YY, et al. Protocol for the examination of specimens from patients with invasive carcinoma of the breast. Coll Am Pathol.2013.
Liu LC, Lang JE, Lu Y, et al. Intraoperative frozen section analysis of sentinel lymph nodes in breast cancer patients: a meta-analysis and single-institution experience. Cancer. 2011;117(2):250–258.
Lyman GH, Temin S, Edge SB, et al. Sentinel lymph node biopsy for patients with early-stage breast cancer: American Society of Clinical Oncology clinical practice guideline update.JinOncol. 2014;32(13):1365–1383.
Manca G, Rubello D, Tardelli E, Giammarile F, Mazzarri S, Boni G. Sentinel Lymph Node Biopsy in Breast Cancer: Indications, Contraindications, and Controversies. ClinNucl Med. 2015; 41(2):126-33.
Marrazzo A, Boscaino G, Marrazzo E, Taormina P, Toesca A. Breast cancer subtypes can be determinant in the decision making process to avoid surgical axillary staging: A retrospective cohort study. Int J Surg, 2015;S1743- 9191(15)01074-2.
Miller CL, Specht MC, Scolny MN, Jammallo LS, Horick N, O‘Toole
J, et al. Sentinel lymph node biopsy at the time of mastectomy does not increase the risk of lymphedema: implications for prophylactic surgery. Breast Cancer Res Treat. 2012; 135(3):781–789.
Nos C, Harding-MacKean C, Fréneaux P, Trie A, Falcou MC, Sastre Garau X et al. Prediction of tumour involvement in remaining axillary lymph nodes when the sentinel node in a woman with breast cancer contains metastases. Br J Surg. 2003.90: 1354–1360.
Poling JS, Tsangaris TN, Argani P, Cimino-Mathews A. Frozen section evaluation of breast carcinoma sentinel lymph nodes: a retrospective review of 1,940 cases. Breast cancer research and treatment. 2014;148(2):355-361.
Reeder-Hayes KE, Bainbridge J, Meyer AM, Amos KD, Weiner BJ,
Godley PA, et al. Race and age disparities in receipt of sentinel lymph node biopsy for early-stage breast cancer. Breast Cancer ResTreat.2011;128(3):863–871.
Tew K, Irwig L, Matthews A, Crowe P, Macaskill P. Meta-analysis of sentinel node imprint cytology in breast cancer. Br J Surg. 2005;92(9):1068–1080.
Turner R, Ollila W, Krasne D, Giuliano A. Histopathologic Validation of the Sentinel Lymph Node Hypothesis for Breast Carcinoma. Ann.Surg. 1997. Vol. 226, No. 3, 271-278.
Vohra LM, Gulzar R, Saleem O. Intra operative frozen examination of sentinel lymph node in breast câncer. J Ayub Med CollAbbottabad.2015 Jan-Mar;27(1):40-4.
Weaver DL, Krag DN, Ashikaga T, Harlow SP. O´Connell M. Pathologic analysis of sentinel and nonsentinel lymph nodes in breast carcinoma. Cancer, 2000. 88:1099–1107. Yildiz R, Urkan M, Hancerliogullarý O, Kýlba. Z, Ozturk E, Mentes MO, et al.Comparison of five different popular scoring systems to predict nonsentinel lymph node status in patients with metastatic sentinel lymph nodes: a tertiary care center experience. SpringerPlus (2015) 4:651. DOI 10.1186/s40064-015- 1442-4.
Zhou W, He Z, Xue J, Wang M, Zha X, Ling L et al. Molecular Subtype
Classification Is a Determinant of Non-Sentinel Lymph Node Metastasis in Breast Cancer Patients with Positive Sentinel Lymph Nodes.PLoS
ONE. 2012;7(4): e35881.





